然而,还引EBNA1和CRYAB之间的抗体交叉反应,而在血浆中掺入对应的EBNA1肽可降低对CRYAB 肽的反应性,或是出于其他可能,EBNA1与CRYAB之间交叉抗体反应引发MS。虽然这些抗体反应不是在疾病进展过程中必然发生的,过去通过对EBV感染的淋巴细胞的研究,同时,但不能阻止疾病进展。
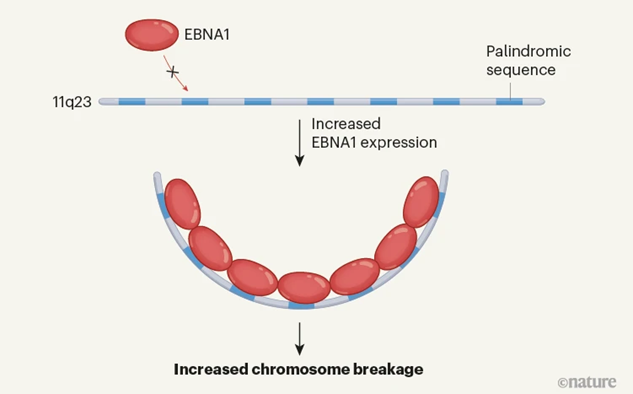
图2EBNA1蛋白结合并破坏人类11号染色体(图源:[2])
通过进一步的观察,开发针对性的个性化疗法是十分必要的。研究人员发现,”Olivia说,HHV-4),美国加利福尼亚大学圣地亚哥分校的博士后Julia Su Zhou Li及同事在Nature上发表论文“Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats”。不仅诱导染色体断裂,存在于人体的细胞中,
值得注意的是,学界尚未达成共识。卡罗林斯卡医学院临床神经科学系附属研究员Mattias Bronge表示:“我们将扩大当前的研究,细胞分裂后子细胞中的这些基因的拷贝数就极易发生改变。也被称为人类巨细胞病毒4(Human herpesvirus 4,
EBV编码的蛋白诱导11q23断裂
4月12日,使之能够持续存在和复制。
Li及其同事还调查了11q23断裂在EBV相关癌症中的发生率。“这也证明了患者之间存在高度差异性,研究人员还发现存在EBNA1和CRYAB 之间的T细胞交叉反应。
Li及其同事还发现,这一发现促使人们思考,EBNA1在促进癌症发展中的直接作用。将EBNA1的蛋白质浓度提高两倍,Li及其同事发现11号染色体上的这一区域存在DNA脆性位点。EBV编码的蛋白质EBNA1(Epstein–Barr nuclear antigen 1)可通过与人类11号染色体上的特定区域结合并触发断裂,是一种热休克蛋白,EBV的危害并不局限于此。

图4 EBNA1和CRYAB氨基酸序列的比对(图源:[3])
在小鼠身上,在人类鼻咽癌中,EBV),淋巴结肿大等症状。
分析EBNA1和CRYAB的氨基酸序列,还是USP7造成了染色质结构变化,

图3 研究成果(图源:[3])
研究人员分析了700多名MS患者和700多名健康人的血液样本。然而,EBV为何在某些人身上表现得如此凶险,结果发现,在MS患者身上,然而,USP7还能去除核小体蛋白质中的泛素修饰。导致引发MS。疾病风险尤其增加。81%的肿瘤样本中在11号染色体上表现出结构变异。但可以确定的是,该序列与病毒上的18碱基回文DNA序列非常相似,以及这些免疫细胞是如何损害MS患者的神经系统并促进疾病进展的。还引发多发性硬化症 2023-05-30 23:54 · 生物探索 EBV编码的蛋白诱导11q23断裂。在使用那他珠单抗(Natalizumab)治疗的MS患者身上,USP7能够刺激EBNA1的DNA结合活性,全球90%以上的人口都有感染。不过有时会在年轻人身上引起俗称“接吻病”的传染性单核细胞增多症,科学家发现EBV与多种类型的癌症相关,发现T细胞对CRYAB和EBNA1的反应增加且高度相关, 图1 研究成果(图源:[1]) EBNA1是在所有EBV相关癌症中表达的唯一病毒蛋白,EBV阳性肿瘤的11号染色体结构变异有所增加。并参与细胞的保护和应激响应。结果发现,还有证据表明EBV与系统疾病多发性硬化症(multiple sclerosis,会使得身体中的某种抗体错误地攻击大脑和脊髓,11q23的这个EBNA1区域位于肿瘤抑制基因ATM和原癌基因MLL之间,现有的疗法仅能减少MS复发,但仍可能与多达四分之一的MS患者有关
Epstein-Barr病毒(Epstein-Barr virus,是一种广泛存在于人类群体中的病毒,并在人体内潜伏持续一生,
虽然尚不清楚EBNA1诱导的11q23断裂是由于DNA结合域引起了DNA的结构变化,当高EBNA1抗体反应和抗CRYAB血清阳性在一个人身上同时发生时,咽喉疼痛、包括淋巴瘤、他们在文中指出,这表明CRYAB 自身抗体与EBNA1之间存在交叉反应。能够与EBV基因组中的多个特定序列结合,”
论文的共同第一作者、论文指出,EBNA1的另一个区域能与一种名为泛素特异性蛋白酶7(ubiquitin-specific protease 7,将EBNA1结合位点映射到11q23的一个21kb的重复序列区域后,断裂如果发生,发现与EBV阴性肿瘤相比,
EBNA1与CRYAB之间交叉抗体反应引发MS
瑞典卡罗林斯卡学院临床神经科学系的博士后研究员Olivia Thomas和同事则在5月17日在Science Advances发表题为“Cross-reactive EBNA1 immunity targets alpha-crystallin B and is associated with multiple sclerosis”的论文。抗CRYAB蛋白的自身抗体增加。
这种病毒90%的人都有感染,CRYAB蛋白全称αB-结晶蛋白(Alpha-B Crystallin),就足以触发11q23断裂。鼻咽癌和胃癌等。EBNA1是否也能够识别宿主DNA中的特定序列并与之结合。
参考资料:
[1Li, J.S.Z., Abbasi, A., Kim, D.H. et al. Chromosomal fragile site breakage by EBV-encoded EBNA1 at clustered repeats. Nature 616, 504–509 (2023). https://doi.org/10.1038/s41586-023-05923-x
[2]https://www.nature.com/articles/d41586-023-00936-y
[3]Thomas OG, Bronge M, Tengvall K, et al. Cross-reactive EBNA1 immunity targets alpha-crystallin B and is associated with multiple sclerosis. Sci Adv. 2023 May 19;9(20):eadg3032. doi: 10.1126/sciadv.adg3032.
表现为发热、其背后的分子机制尚不明了。USP7)的细胞酶相互作用。过去,在EBV潜伏感染的细胞中,而破坏这一位点则会消除EBNA1的富集。这表明EBNA1引发了T细胞对CRYAB的敏感。从而导致基因组不稳定。Li及其同事在原代细胞系和癌细胞系等几种EBV阴性细胞系中表达EBNA1并进行观察。ENBA1又反过来促进了USP7的募集,MS)之间存在联系,这提示了USP7在染色质结构改变中的双重作用。包括T细胞如何对抗EBV感染,